写在前面
你好,我是思考问题的熊,本内容是参加会员计划读·者的专属内容,感谢你通过会员计划支持我持续创作。展信佳~
本期内容:
在关于生物标志物 HRD 的前两期内容中,我们分别了解了 HRD 作为生物标志物的提出 和 临床核心应用场景,具象感受了一个生物标志物从逐渐被人们认知到接受,究竟需要经历怎样的过程。
在本期内容中,我们将继续了解 HRD 这种生物学现象可以如何检测以及目前市面上那些相关的国内外产品,共同感受一下当 HRD 被人们认可后,各家国内外厂商的跟进方式。(本期内容字数 5700+)
下期预告
下期内容中,我将和你分享一些自己关于 HRD 及相关产品目前临床应用的困惑和思考。
HRD 检测思路
笼统讲,检测一个生物学现象可以从两个维度出发:检测造成这个生物学现象的原因;检测这个生物学现象导致的结果。
具体讲,针对同源重组修复缺陷,我们既可以考虑检测其原因,例如对应通路的 BRCA 或其它基因突变,BRCA 启动子甲基化等等;也可以考虑检测同源重组修复缺陷造成的结果,也就是所体现出的基因组不稳定性。
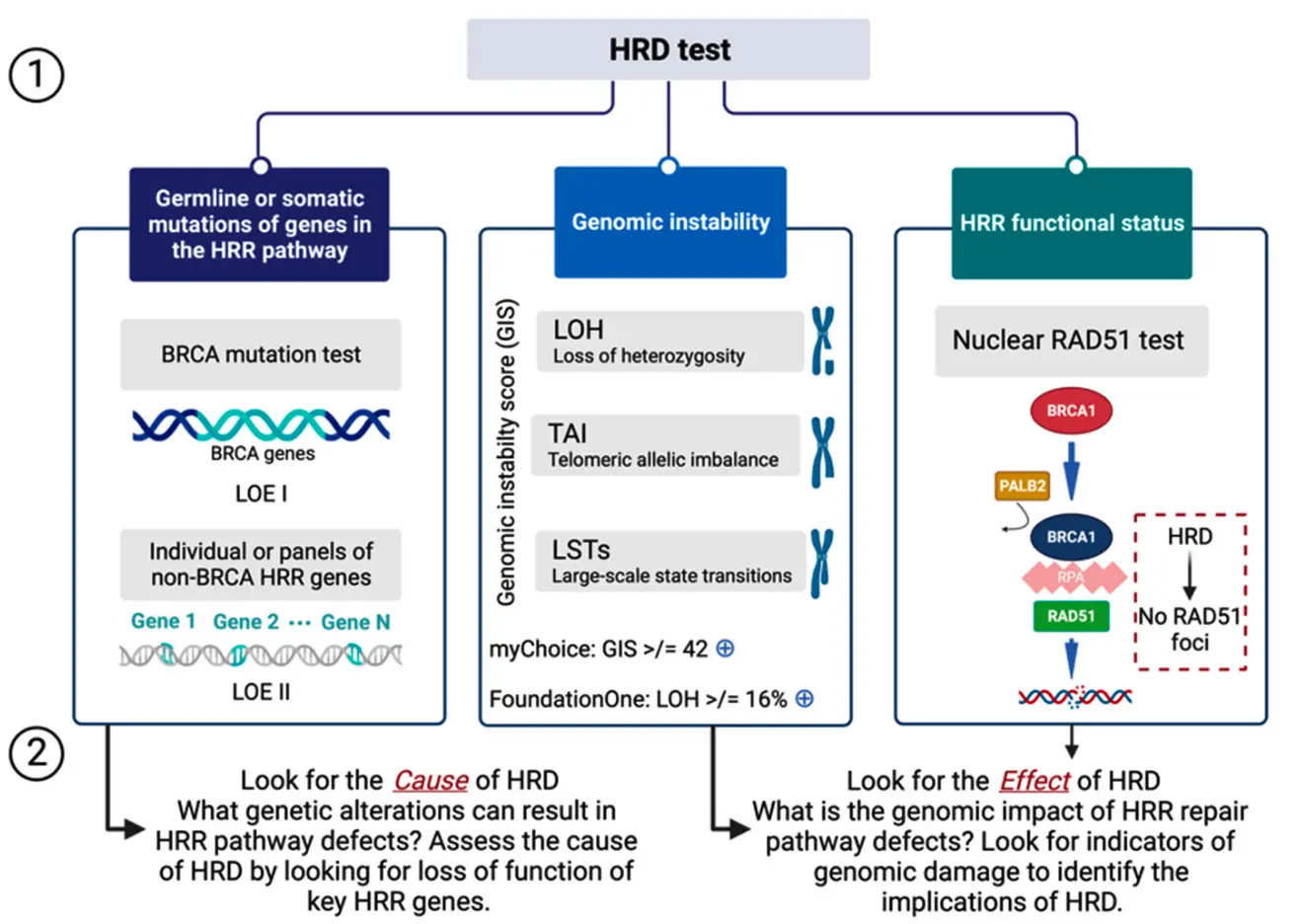
HRD 检测产品
Myriad MyChoice

在介绍 HRD 的临床验证过程时,我们就反复提到了 Myriad 这家公司和它的 HRD 检测产品。说到 Myriad,这家成立于 1991 年的公司在肿瘤 NGS 检测历史上有非常重要的地位,在后续国内外知名公司系列内容中,我们会继续深入了解它。
在这里,你只需要知道他们早在 1994 年就申请了关于 BRCA 遗传基因以及其诊断方法的相关专利,且这件事情引发了后来一系列接近 20 年的 基因是否可以作为专利的争论。从 BRCA 到 HRD,Myriad 能走在 HRD 检测的最前列也似乎是情理之中。正如在上一期通讯的中,我写到:
至此,这几项大型的三期临床研究一方面证实了几家 PARPi 在卵巢癌维持治疗中的作用,另一方面因为他们都不约而同选择了 Myriad 的 MyChoice 检测产品,也让 Myriad MyChoice 事实上成为了 HRD 检测临床使用的「金标准」。

HRD 会产生特定、可量化、稳定的基因组改变,其中包含可鉴别突变、插入/缺失,以及染色体结构异常、基因拷贝数变异等,这也是当前构建 HRD 临床检测主流方法的理论基础。
HRD 临床检测所描述的肿瘤基因组特定改变也被称为「基因组瘢痕」。自 2012 年以来,杂合性缺失(loss of heterozygosity,LOH)、端粒等位基因不平衡(telomeric allelic imbalance,TAI)、大片段迁移(large-scale state transition,LST)等被作为基因组瘢痕标志物,以量化基因组瘢痕程度。
如同他们在 2016 年发表的论文,Myriad 将自己家 HRD 评估的产品命名为 MyChoice 和后来升级版的 MyChoice Plus,并将 HRD score 定义为 LOH + TAI + LST 加和(这部分具体内容可以参考 part1 部分正文)。
详细地说,LOH 定义为大于 15 Mb 且小于整个染色体长度的杂合性缺失;TAI 定义为延伸到其中一个亚端粒但不超过着丝粒且大于 11 Mb 的等位基因不平衡的染色体片段;LST 定义为两个相邻区域(两个区域长度均大于等于 10 Mb,且区域间距小于 3 Mb)之间的染色体断裂位点的总数。
LOH、TAI 和 LST 等 3 个指标都有独特的定义,在一定程度上都能描述细胞 HRD 状态的程度。然而,相较单个指标描述,三者组合综合计算评分能更全面反映基因组瘢痕状态,进而对基因组不稳定状态进行评估。所以 MyChoice 就是以 BRCA 1/2 的致病性变异状态加上基因组不稳定评分(genomic instability score,GIS)来评估 HRD 状态。
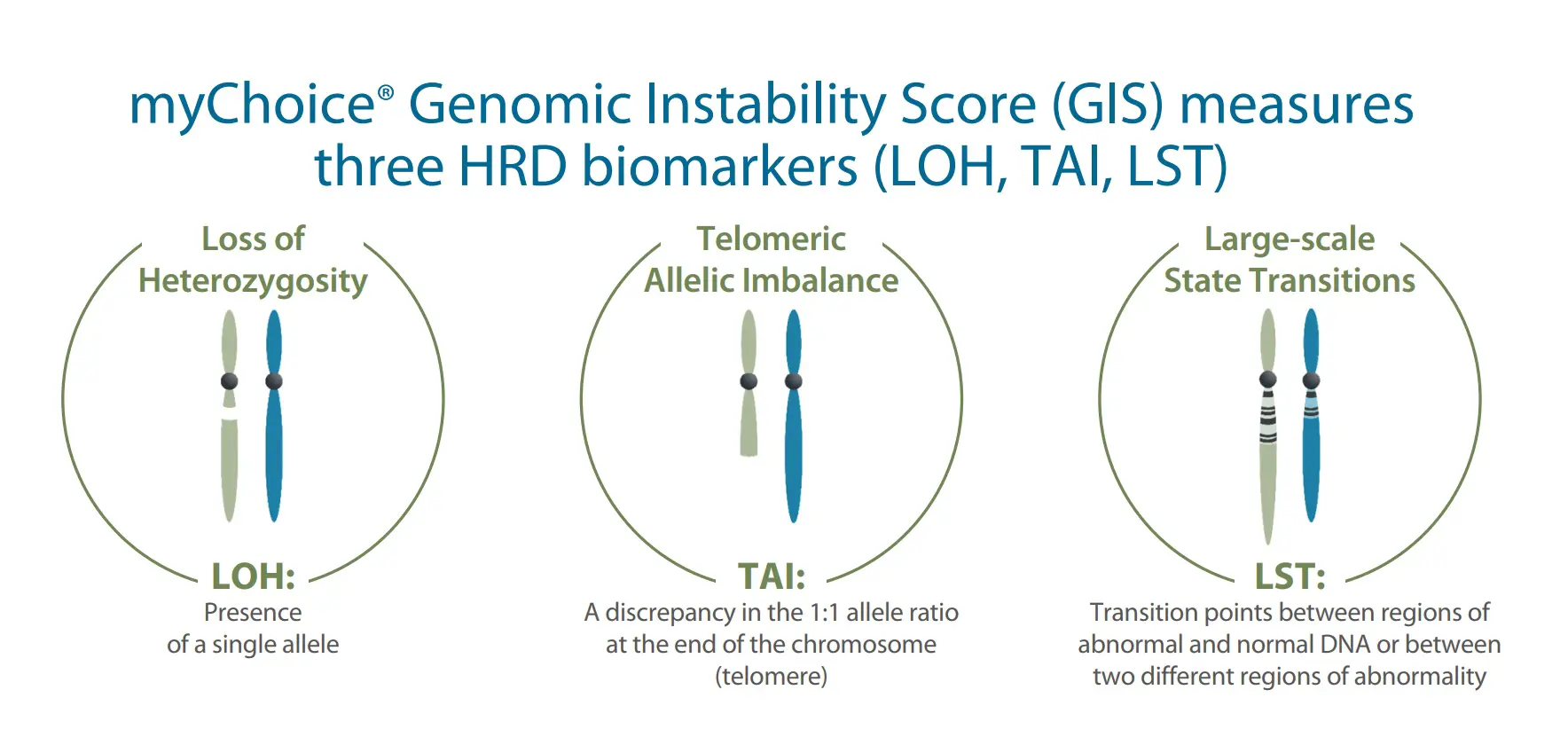
如果你还记得在 part1 中,我们提到了最早论文中 LST 这个指标需要进行基因组倍性矫正,进而会产生负数,但随后它们取消了这个矫正,让这个计算更容易理解。
这里多说几句。
对于不同组合构成的模型,我们往往会通过添加系数的方式,给每个不同的指标分配不同的权重,进而取得最好的预测效果,类似与 Y = 0.2A + 0.65B + 0.3C,但为什么 LOH TAI 和 LST 这三者刚好就是同等系数的简单加和效果最好呢?
其实,很早一期 Myriad 团队成员自己录制的播客节目 Myriad Live - Let's Talk HRD 中,它们给了这样一个解释:看似同等重要,其实并非如此。
如果你看一下等式,它们看起来是同等权重的,因为我们所做的就是把它们加在一起,但实际上,LST 分数的动态范围大约是其他两个分数的两倍,所以这意味着它对最终分数的贡献比 LOH 或 TAI 更大。
它往往比其他两个分数更高,所以我们实际得到的结果是,大约一半的最终分数来自 LST,平均大约四分之一来自 LST 和 TAI。
我们之所以对最后的设置感到满意,并发现它表现最好,部分原因是在我们早期的研究中发现 LST 实际上是 HRD 的最佳预测因子。因此,它比 LOH TAI 在数值上更重要,几乎占最终分数的一半。
如果你想更加具体的了解 myriad 官网自己对于这款产品的介绍,可以详细阅读下面的两个链接。
MyChoice® CDx HRD Companion Diagnostic Test | Myriad Genetics
- The most comprehensive tumor test to determine HRD status in patients with ovarian cancer1
- The first and only FDA-approved tumor test that determines HRD status using BRCA status and Genomic Instability Status
- This FDA-approved test helps provide information on the magnitude of benefit for PARP inhibitor therapy
MyChoice CDx Plus | Myriad International
Foundation One gLOH
虽然在 PRIMA,PAOLA-1 和 VELIA 的三项研究中都使用了 Myriad 家的产品,但另外一款 PARPi 鲁卡帕利则选择和 Foundation medicine 进行合作。
2017 年 1 月,The Lancet Oncology 发表了 ARIEL2 临床试验(NCT01891344)的研究结果。
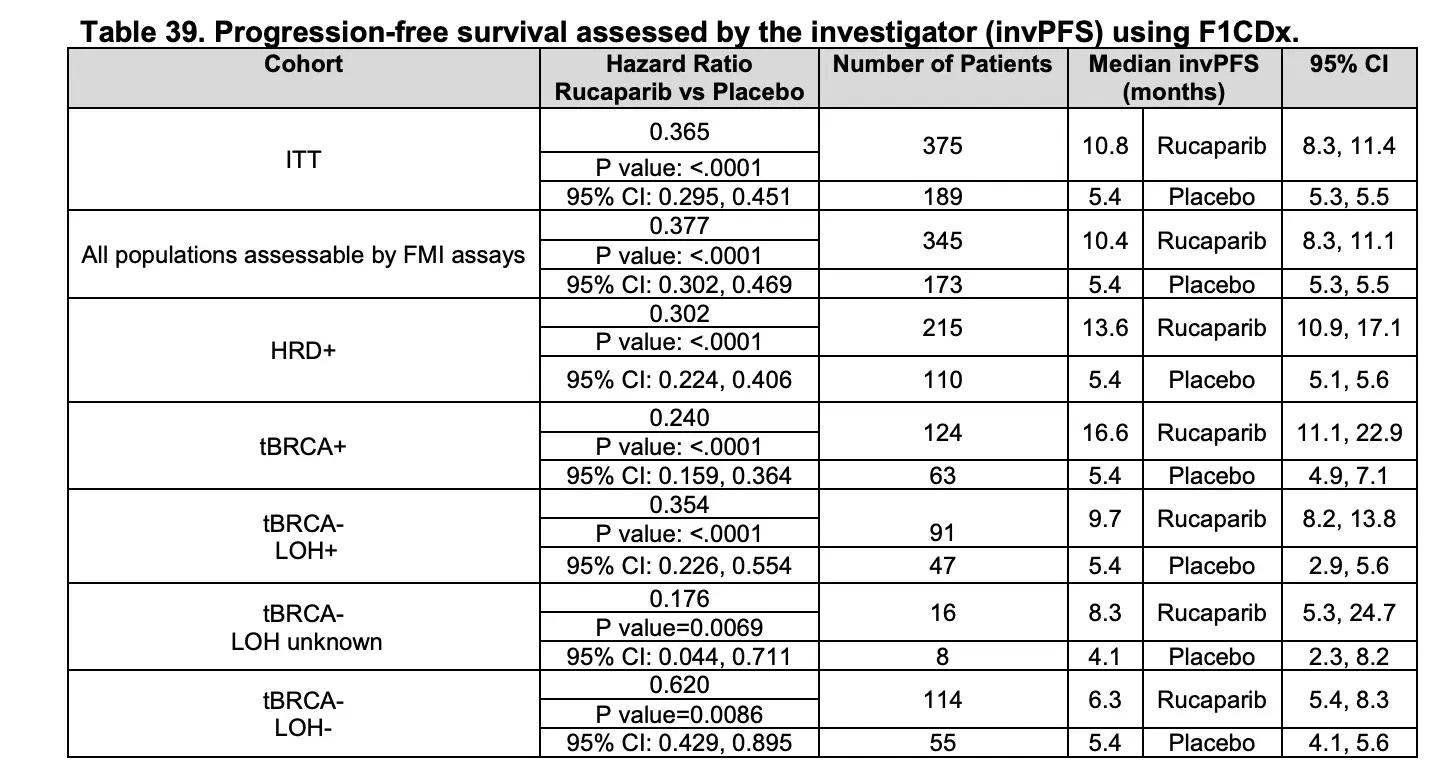
其中一个研究结论是 BRCA1/2 野生型铂敏感卵巢癌高 LOH 的患者对鲁卡帕利的反应比低 LOH 的患者好,证明了 PARP 抑制的潜力可以扩展到 BRCA1/2 突变的肿瘤之外。
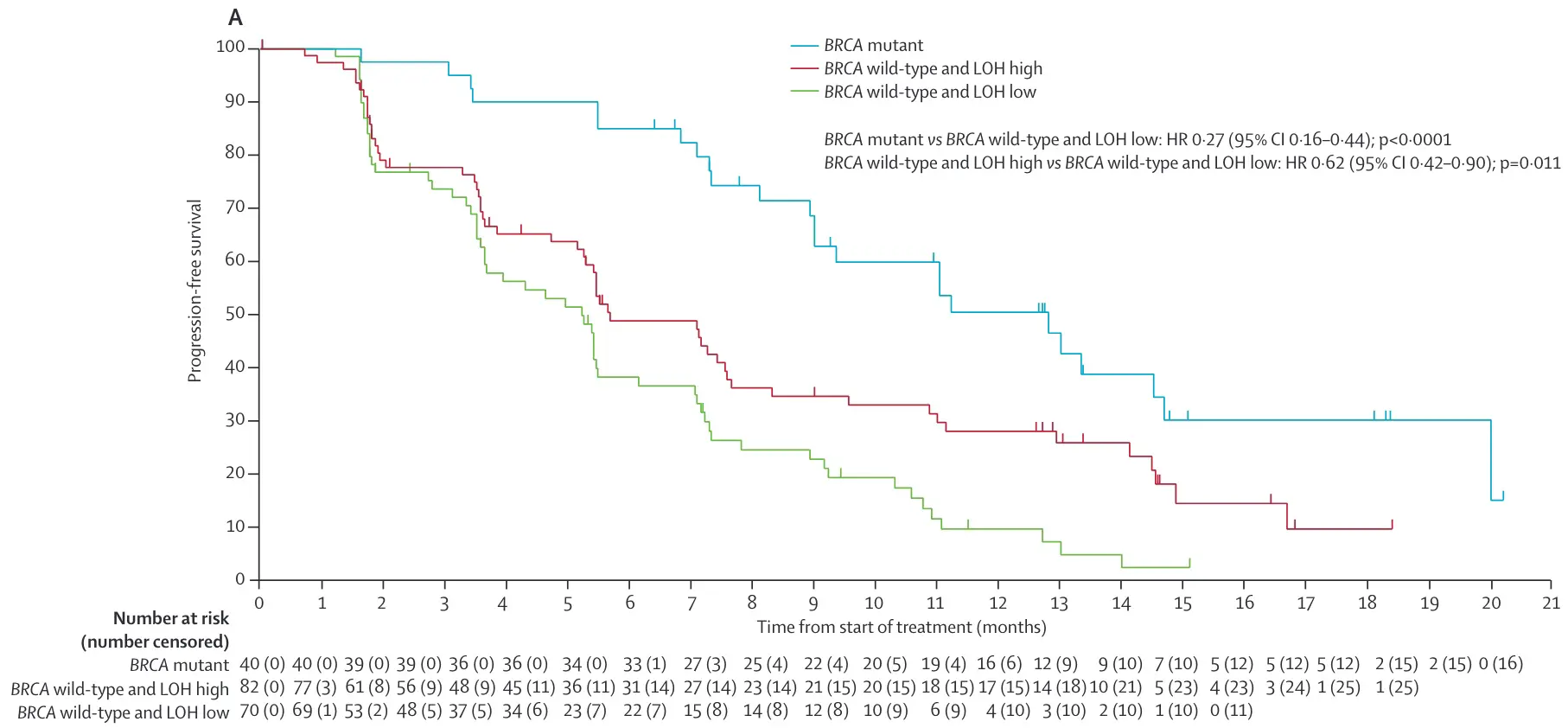
在这篇文章的补充材料中,描述了 gLOH 的大致计算方法,依赖于 F1 panel 中在全基因范围内铺设的 3500 个 SNP (对应的 myriad mychoice 覆盖的 SNP 为 27000)和基因覆盖的 SNP,可以计算出基因组发生 LOH 的比例。

紧接着 2017 年 10 月,ARIEL3 发表在 The lancet。

研究同样采用了 FoundationOne CDx(F1CDx)检测 LOH 确定 HRD 状态,其中高 LOH 阈值为 16%,HRD 阳性定义为 BRCA 突变或 BRCA 野生型但高 LOH。探索性分析显示,鲁卡帕利维持治疗组 LOH 高的患者较 LOH 低的患者中位 PFS 延长,而安慰剂组中,LOH 高组与 LOH 低组患者的中位 PFS 均为 5.4 个月。
基于上述研究结果,F1 (之前叫 FoundationFocus BRCA LOH,后被整合到 F1 中)被 FDA 批准用于鲁卡帕利维持治疗复发高级别浆液性或子宫内膜样卵巢癌患者的补充诊断,以期筛选出更多可能获益的 HRD 阳性患者。