写在前面
你好,我是思考问题的熊,这里是参加会员计划读者的专属内容,感谢你通过会员计划支持我持续创作。展信佳~
如果你还没有加入我们的会员读者群,邮件通讯就是唯一的联系渠道了,我需要向你汇报一下最近的个人动态。(进群方式在文末哦)
最近一段时间拖更了会员计划内容,主要是两个原因:一是工作搬砖又出现了比较频繁的加班,二是下个月因为疫情拖了两年的婚礼要举行,有些事情需要准备。这两个情况,导致本是高强度输出的晚上和周六日变得有点不可控。
另外一个情况是目前的更新模式下每一期的工作量都很大,导致一篇稿子迟迟不能收尾和你相见。在规划会员计划时,我预计每篇文章不超过两千字,但实际写下来刹不住车,基本都是五六千甚至是八九千字的体量。有订阅的小伙伴开玩笑说,每次打开之前多少有点压力,感觉不是在看文章而是在看综述。
针对第一个问题,自己正在探索一点点工作上的调整,个人生活上的事情还有两三周就告一段落了。针对第二个问题,读者群里的反馈让我意识到大家其实更需要高频的触达,而非等很久的大招。
之后,我会尽可能控制每一次会员通讯的长度,一年40篇文章(或者说不少于8万字)内容的交付问题不大。所以,我们会更频繁的相见,但读和写的压力都会小些。当然,整体内容规划和系统性不受影响,在更新一年左右的时间节点,我会把所有会员计划内容整理成一个完整优雅的PDF文集,方便参加全年计划的小伙伴阅读参考。
学会给一篇文章、一件事情和一段生活收尾,也许是你我都要持续学习的功课。
好啦,个人近况汇报就到这里,最近的生活还有些其它体会,留待常规邮件通讯再聊,我们言归正传。
在上期中,我们聊到了HRD/DDR 生物学背景、临床应用场景和临床验证历程的前半部分内容(2010-2016年),这几年经历了从HRD方法学基础的发表,到HRD score的提出,再到HRD score的阈值确定过程。 因为间隔时间比较久, 你不妨先回顾一下。 V016plus.熊言熊语:biomarker-同源重组修复缺陷HRD (part1)
本期内容:
你将阅读到HRD临床验证的后半部分历程(2016-2020年),这几年多个重要的临床实验发表证实了PARPi的临床价值,同时也顺便验证了HRD的价值(主要为 Myriad MyChoice 产品)。结合上期和本期内容,我们可以具象感受到一个生物标志物从逐渐被人们认知到接受,究竟需要经历怎样的过程。
下期预告
了解 HRD 作为生物标志物目前在临床的核心应用场景后,下期我们就会了解 HRD 这种生物学现象还可以如何检测以及市面上对应的那些国内外产品。
临床应用场景
2016 年 NOVA 研究

2014年12月FDA批准了首个PARP抑制剂——奥拉帕利(orlaparib),用于治疗晚期卵巢癌或携带BRCA基因突变的卵巢癌。
2016年发表在NEJM的一项名为NOVA的随机双盲 3 期试验中,另一款PARPi 尼拉帕利(niraparib)在铂敏感型复发卵巢癌患者维持治疗中展现了极为良好的疗效。研究人员招募了553例铂类化疗后复发卵巢癌患者,并根据是否带有生殖系BRCA基因突变,进行了安慰剂对照的随机临床试验。在带有BRCA突变的组中,经过尼拉帕利治疗的患者无进展生存期的中位数长达21个月,明显长于对照组的5.5个月。
令人兴奋的是,该研究还证实:不论患者为何种基因背景,尼拉帕利均可显著延长患者的无进展生存期,只是该作用在BRCA基因突变携带者或DNA同源重组修复功能缺陷(HRD)的人群中更明显。彼时尼拉帕利为治疗铂敏感型复发的卵巢癌患者带来了新曙光。
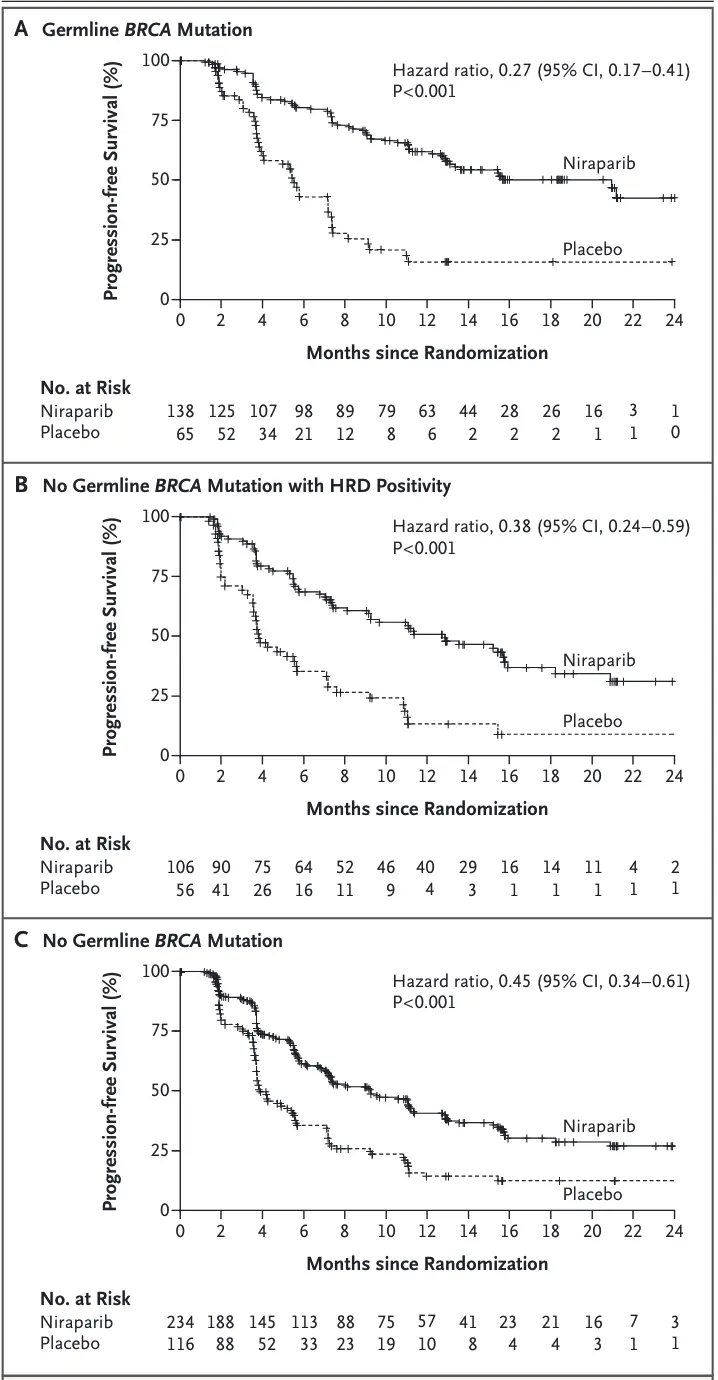
详细阅读论文相关材料,可以发现一个有趣的事。其实在制定研究方案时还不清楚几个候选生物标志物中,哪一个适合作为接受过多种铂类疗法的患者使用尼拉帕利作为维持治疗的辅助诊断(CDx)进行评估。因此,最初临床研究目标之一就是利用研究数据来选择一个生物标志物并确定一个适当的阳性阈值。
研究开展后不久,Myriad 便开发了一种基于DNA测序的HRD检测产品:myChoice 。原理就是我们在上一篇文章末尾提到的检测方法,又有点忘记了就回去复习一下~
于是,这个研究目标实验开始没多久就不再需要探索了,他们决定直接使用HRDscore >= 42 作为同源重组修复缺陷的标准进行分组研究。在 HRD-阳性加体细胞BRCA突变的患者以及那些具有胚系BRCA突变的患者中观察到类似的风险比,体现了该药物在患者人群中反应的一致性。
2018年 SOLO1 研究
再来说说奥拉帕利。
名为 SOLO 1 的三期试验在 2018 年底发表,结果说明患有新诊断的晚期 BRCA 突变卵巢癌患者,手术和化疗后接受 PARP 抑制剂奥拉帕利(Olaparib)的维持治疗与不接受维持治疗相比,疾病进展或死亡风险降低了 70%。
这个结果结果不仅使 FDA 批准了奥拉帕利(Olaparib)用于这一适应症,也代表着在治疗BRCA突变卵巢癌患者方面又向前迈出了一大步。不过这项研究使用了 Myriad 的 BRACAnalysis test 产品进行 BRCA 检测,并未涉及到 HRD 评分。
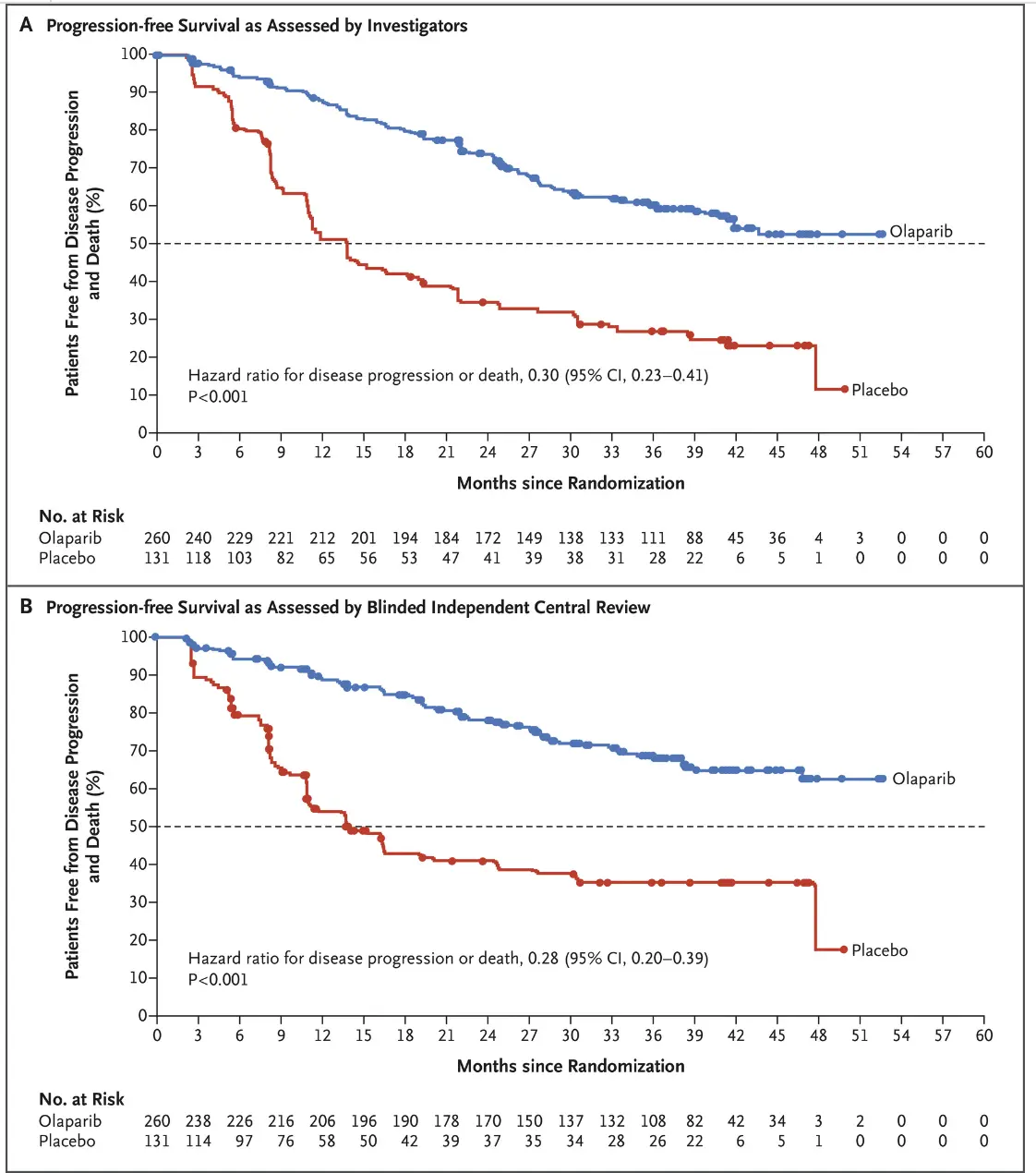
紧接着,2019 年又有三项三期临床试验结果发表。它们分别是 PRIMA、 PAOLA-1 和 VELIA 研究,这些试验考察了 BRCA1/2 突变患者以外的一线 PARP 抑制剂使用,它们分分展示了 HRD 相关亚组的临床结果。
2019 年 PRIMA 研究

根据 NOVA 实验,尼拉帕利已被批准在对铂类化疗产生应答的复发性卵巢癌患者中用作维持治疗。而 PRIMA 试验的主要目的是在新诊断出晚期卵巢癌且复发风险高的患者中检测患者对铂化疗产生应答后,尼拉帕利维持治疗的疗效和安全性。
在这项随机、双盲、3 期试验中以 2∶1 的比例将新诊断的晚期卵巢癌患者随机分组,两组分别在对铂类化疗产生应答后接受每日 1 次尼拉帕利或安慰剂治疗。此时,同源重组缺陷已经被定义为 BRCA 存在致病变异或者 MyChoice 的HRD评分高于 42。
在接受随机分组的 733 例患者中,373 例(50.9%)表现为同源重组缺陷。在这一类别的患者中,尼拉帕利组的中位PFS显著超过安慰剂组(21.9 个月 vs 10.4 个月,HR为 0.43)。在总人群中,两组的相应PFS分别为 13.8 个月和 8.2 个月。在 24 个月时的期中分析中,尼拉帕利组和安慰剂组的OS分别为 84%和 77%(风险比,0.70;95% CI:0.44 - 1.11)。
也就是说,在新诊断的晚期卵巢癌对铂类化疗产生应答的患者中,无论是否有同源重组缺陷,尼拉帕利组的PFS均显著超过安慰剂组
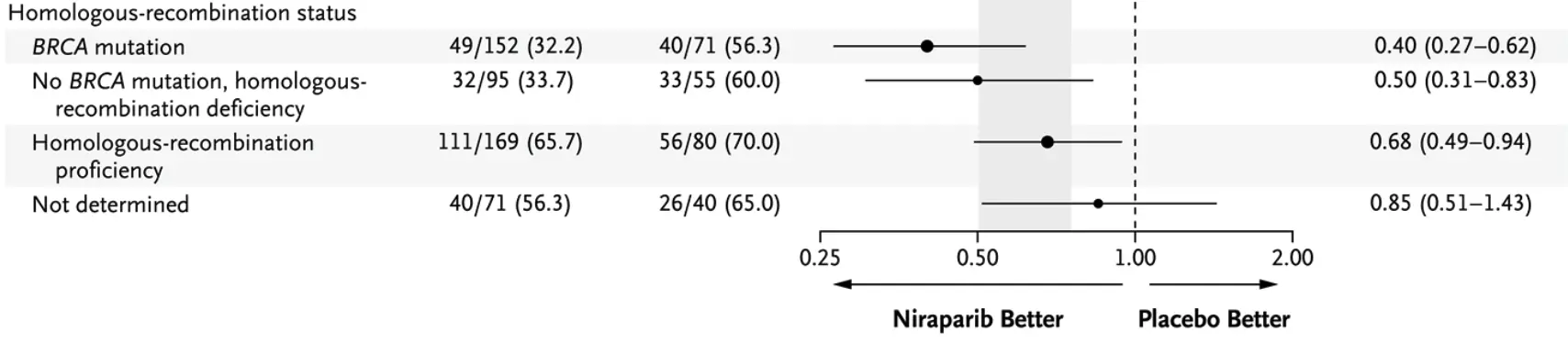
多说一句,在 myriad 产品文档中给出了对该研究的总结,我也放在这里供你参考。
Niraparib PR-30-5017-C (PRIMA) for maintenance treatment.
The niraparib clinical study PR-30-5017-C (PRIMA) was a randomized, double-blind, placebo-controlled, multicenter Phase 3 study design in subjects with ovarian, fallopian tube, and primary peritoneal cancer, collectively referred to as ovarian cancer. The objective of PRIMA was to evaluate the therapeutic effect of maintenance niraparib treatment following response to first-line platinum-based chemotherapy in patients with advanced ovarian cancer