写在前面
你好,我是思考问题的熊,本内容是参加会员计划读者的专属内容,感谢你通过会员计划支持我持续创作。展信佳~
在2022年的最后一个工作日晚,提前祝你新年快乐。2023,我们继续一起前行。
本期内容:
在癌症治疗领域,一个又一个振奋人心的新药被开发出来,尽管这是巨大的进步,但它也带来一个新的难题:如何更好地结合许多新的药物以获得持久疗效。
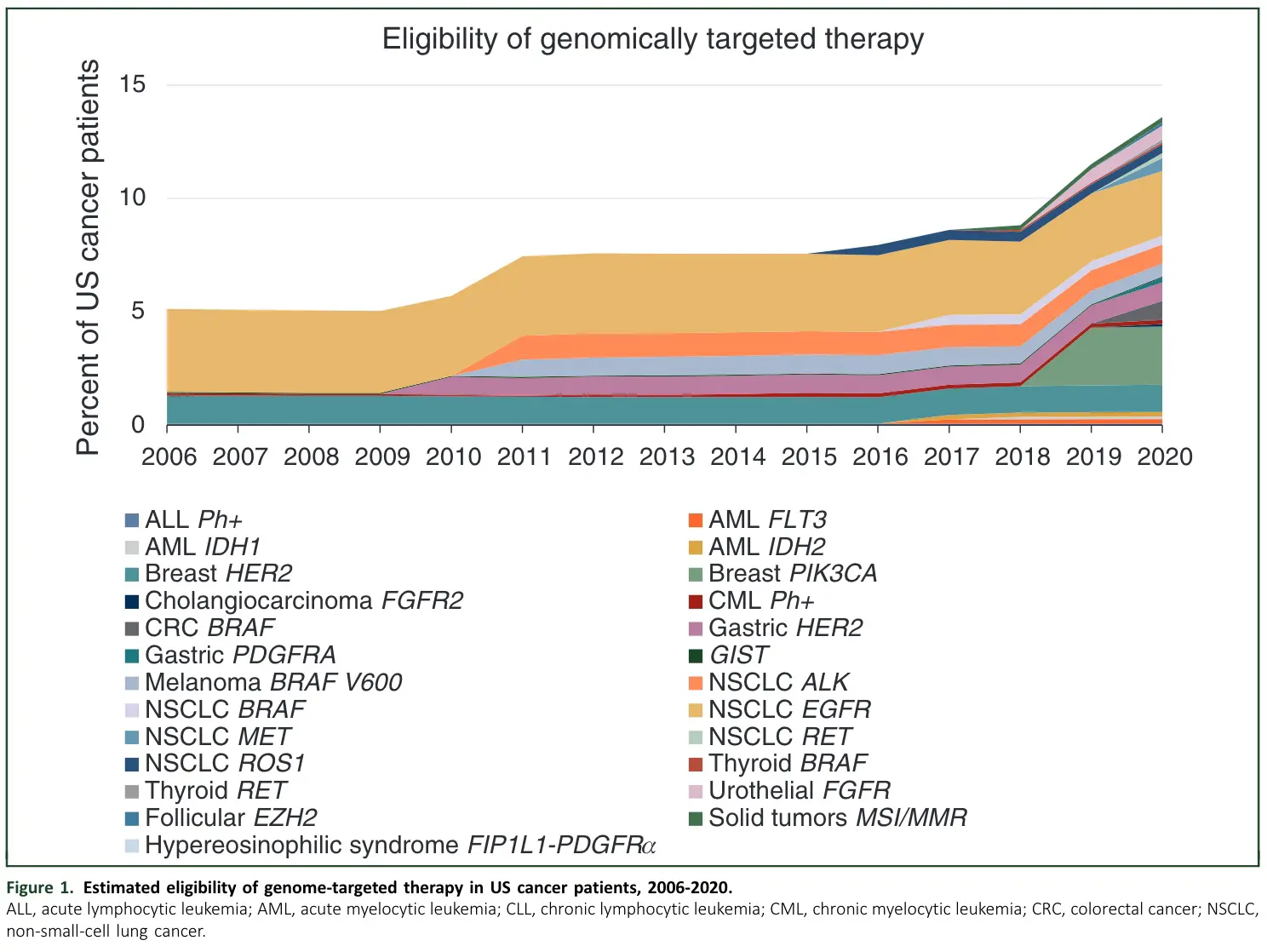
2006年至2020年间,美国食品和药物管理局(FDA)共批准了72种不同的靶向药物,用于18种癌症的36种基因组适应症。这些药物的批准让符合基因组靶向治疗的患者数量逐渐增加,一项基于美国患者的研究显示从2006年的5%增加到2020年的13.6%。
尽管很多靶向治疗药物最初可能非常有效,但单药治疗的耐药仍然是一个重大挑战。耐药研究是肿瘤NGS领域一个非常重要的研究主题,这其中包括各类靶向治疗耐药和免疫治疗耐药。
本期内容我们将围绕靶向治疗的耐药机制这一话题进行了解,主要包括如下四部分内容
- 靶向治疗核心原理
- 靶向药物的原发性耐药机制
- 靶向药物的获得性耐药机制
- 肿瘤内异质性对耐药的影响
下期预告:
面对耐药,联合用药有时有助于克服耐药性,但药物组合的数量远远超过了可以进行临床试验的数量,此外还需要综合考虑患者承受的经济负担以及毒副作用等等。
因此,我们需要基于对耐药性相关潜在分子机制的深入了解,来确定潜在有效的药物组合抗耐药性。下期内容我们将会从本期的耐药机制出发,一起了解联合治疗策略和相关最新的研究进展。
以下为本期内容正文,7000字余字。
靶向治疗核心原理
如我曾经在 跨越60年的癌症靶向治疗里程碑 这篇文章里提到的,过去二十年里,对癌症基础的研究使得我们拥有了大量的新型癌症靶向药物。
自从伊马替尼成功开发,用于治疗BCR-ABL驱动的慢性骨髓系白血病以来,「一个基因异常对应一种药物」就被认为是一种新的药物开发范式。
这一概念加速了一系列癌症靶向治疗的发现。不过,伊马替尼的成功在一定程度上误导了药物研发,因为这些患者在使用伊马替尼单药治疗时可以出现长时间的响应,但是多数其它靶向药物对单药治疗的反应却不持久。
2006年至2020年间,美国食品和药物管理局(FDA)共批准了72种不同的靶向药物,用于18种癌症的36种基因组适应症。这些药物的批准让符合基因组靶向治疗的患者数量逐渐增加,一项基于美国患者的研究显示从2006年的5%增加到2020年的13.6%。
在了解肿瘤相关的基因时,早期我们通常会把基因分为oncogene和tumor suppressor gene(TSG)。在提到多数靶向治疗时,我们多数关注的其实是oncogene发生gain-of-function的这种获得功能的显性突变,这类基因通常功能与细胞的增殖、生长与分化相关,其突变可以造成基因过度活跃,因而在癌症中抑制这些基因就可以限制癌症。
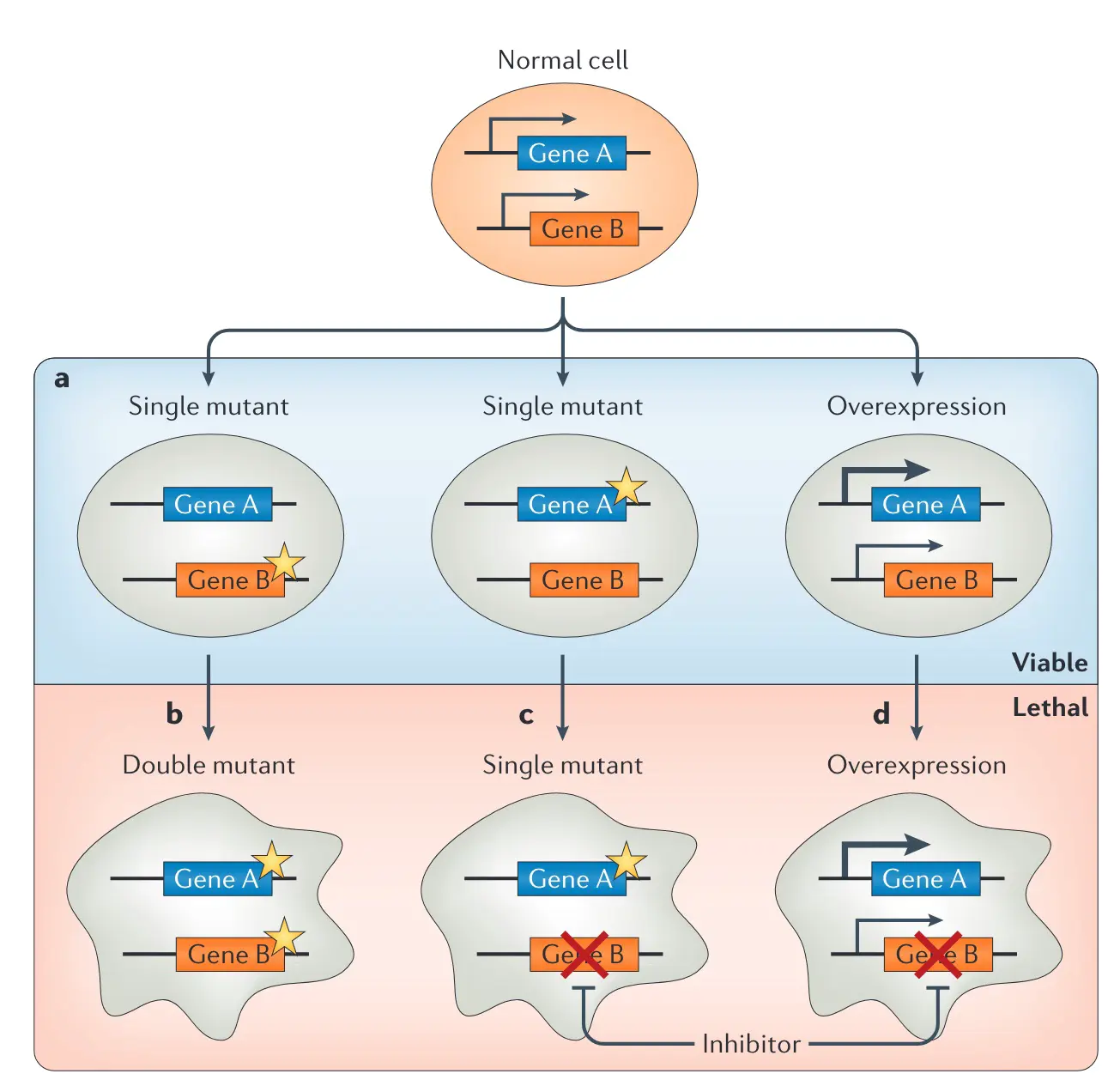
而TSG常见的突变是loss-of-function,这些突变造成的蛋白功能丧失在早期的研究中认为没有办法用来指导治疗决策和直接用药,但是合成致死(synthetic lethality)这一机制的提出改变了TSG LOF 无用的观点。
所谓合成致死,就是A和B两个基因任何一个突变都可以被容忍,但是如果AB两个基因同时突变就会导致细胞死亡。原则上,当两个突变对一个基础的生物学通路产生相加的负影响,或者当两个突变使两个不同但功能重叠的通路失活时,就可能导致合成致死。
在癌症治疗中,如果一个不可药用的TSG的LOF可以诱发对第二个基因的依赖,那么这个基因本身就是一个很好的药物靶点,能使TSG的LOF可以间接药用。针对一种对癌症相关突变具有合成致死的基因,应该只杀死癌细胞,而不会杀死正常细胞。因此,合成致死为开发癌症特异性药物就提供了一个新的概念性框架。
关于合成致死在肿瘤治疗领域目前最成功的应用就是BRCA突变的癌症对PARP抑制剂具有选择敏感性。
BRCA突变会使肿瘤细胞同源重组介导的DNA修复存在缺陷(双链修复),因此它们高度依赖PARP介导的碱基切除修复(单链修复),如果针对BRCA突变的癌症使用PARP抑制剂,既可以组织DNA修复。
如果负责双链断裂修复的BRCA突变失活,再把单链断裂修复的PARP抑制,癌细胞的DNA修复系统就会被破坏进而死亡。到目前为止,PARP抑制剂已被批准用于与BRCA1/2基因突变有关的卵巢癌、乳腺癌、前列腺癌和胰腺癌的临床使用。
不管是以上哪种机制或者是那种靶向药物,尽管它们最初可能非常有效,但单药治疗的耐药性仍然是一个重大挑战。
面对耐药,联合用药有时有助于克服耐药性,但药物组合的数量远远超过了可以进行临床试验的数量,此外还需要综合考虑患者承受的经济负担以及毒副作用等等。
因此,我们需要基于对耐药性相关潜在分子机制的深入了解,来确定潜在有效的药物组合来对抗耐药性。